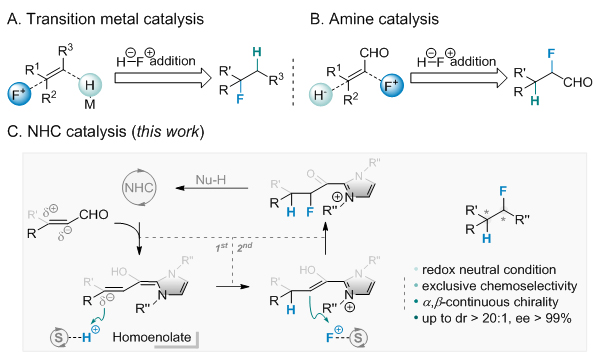
从广泛存在的双键骨架出发,氢氟化反应是构建含氟手性中心化合物的高效途径,可用以储备一系列活性潜药物种。在已报导的合成法学中,居多利用氢负物种对双键的加成,串联原位碳负离子对氟正物种的捕获,在强还原性氛围下完成含氟骨架的搭建。这一催化模式始终面临两种反应试剂(H-与F+)互为拮抗的情况,导致操作上不可避免的繁琐。而较为割裂的分步反应模式,使得连续手性中心的一步构建变得困难。
基于此命题,黄湧课题组提出新颖的氢正-氟正串联反应模式,一步实现烯醛化合物的不对称氢氟化反应,在氧化还原中性条件下构建α,ꞵ-不对称含氟羰基化合物。此前,该课题组发展仿生迁移的“质子梭”策略,通过手性氮杂卡宾 (N-heterocyclic carbenes, NHCs) 介导β-双取代烯醛化合物的不对称质子化反应 (J. Am. Chem. Soc. 2017, 139, 7045; Chem. Commun. 2018, 54, 1473; Angew. Chem. Int. Ed. 2018, 57, 8503; Acta Chim. Sinica 2018, 76, 850)。在此基础之上,通过反应物种实时浓度及内观性质的平衡调控,实现催化循环过程中额外的不对称氟化步骤的引入,以完整的化学选择性、非对映选择性及对映选择性得到目标官能团化产物,成果在线发表于《德国应用化学》,题为“Enantio- and Diastereoselective Hydrofluorination of Enals via N-Heterocyclic Carbene Catalysis”(Angew. Chem. Int. Ed. 2019, DOI: 10.1002/anie.201902989)。
氮杂卡宾介导的氢氟化反应
这一策略以氮杂卡宾的“极反转”催化效能,实现烯醛化合物ꞵ-位点的亲核性 (Homoenolate),对接“质子梭”的氢正转移步骤,实现不对称质子化。随后,平衡α-位点的亲核氟化效率以及亲核试剂对催化剂的循环效率,实现不对称氟化。在这一氧化还原中性条件下,诸多反应官能团可被容忍,包括杂原子芳环、酰胺键、酯基、孤立双键、磷酸酯及Michael受体等,均可顺利得到目标的不对称氢氟化骨架。该合成方法亦初步论证其在复杂骨架后期修饰中的应用,以较高效率获得类药含氟手性化合物。
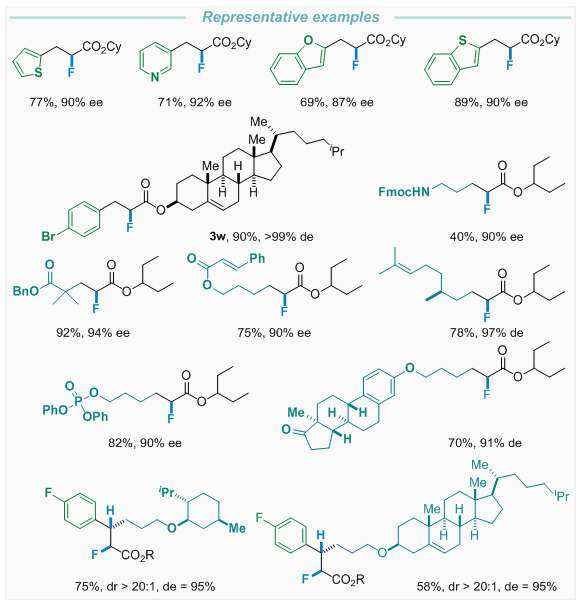
烯醛的不对称氢氟化
以上工作由黄湧教授、陈杰安副研究员共同指导,由博士后王乐明、博士研究生江新航共同完成,依托于北京大学深圳研究生院肿瘤化学基因组学国家重点实验室平台,得到了国家自然科学基金委员会及深圳市科技创新委员会的资助。
论文链接:https://onlinelibrary.wiley.com/doi/10.1002/anie.201902989
文字:陈杰安