近日,《美国化学会志》发表北京大学深圳研究生院全军民课题组在维生素B12生物合成酶催化机理研究方面取得的新进展。
北京大学深圳研究生院化学生物学与生物技术学院全军民课题组,利用密度泛函理论(DFT)对维生素B12关键片段5,6-二甲基苯并咪唑(dimethylbenzimidazole,DMB)生物合成的酶催化机理进行研究,取得突破性进展。提出的中间体辅助的多功能催化机理不仅合理地解释了BluB的酶催化过程,而且对理解酶催化的进化过程给予重要的启示。
维生素B12,在维生素中化学构成最为复杂,是唯一的一个只能由微生物来合成的维生素,它对人类健康十分重要。有关维生素B12的研究已经获得过4次诺贝尔奖。但是这个分子的关键性片断5,6-二甲基苯并咪唑(dimethylbenzimidazole ,DMB)的生物合成在最近50年一直是未解之谜。2007年美国麻省理工学院(MIT)的科学家们在自然杂志《Nature》发表他们的重要发现,确定一种黄素破坏酶(flavin destructase)BluB负责DMB的生物合成,为科学家50年来探究维生素B12复杂分子合成机制的历程画上了句号。然而该发现又给人们提出新的迷题,BluB的催化位点非常简单,但它催化黄素降解形成DMB的反应却极其复杂,涉及一个C-C键和两个C-N键的断裂,以及一个C-N键的形成。全军民课题组利用理论计算化学的方法阐清了这个复杂的过程,BluB催化了氧气的插入以及两个C-N键的断裂,形成苯二亚胺和四氧嘧啶中间体,然后BluB利用中间体四氧嘧啶作为一个多功能的辅酶,催化后续不少于十步的反应。这是酶催化领域首次发现的中间体辅助的多功能催化机制,与之前发现的底物辅助和产物辅助酶催化机制一起为理解酶催化的进化过程勾勒了完整的图片。
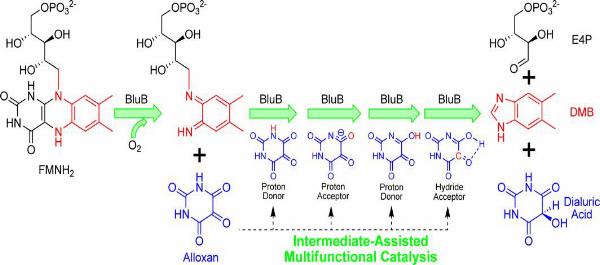
上述成果发表在2011年2月23日在线出版的《美国化学会志》上(Journal of the American Chemical Society):“Intermediate-Assisted Multifunctional Catalysis in the Conversion of Flavin to 5,6-Dimethylbenzimidazole by BluB: A Density Functional Theory Study”.
论文网址:http://pubs.acs.org/doi/abs/10.1021/ja1106207