韩伟课题组和李子刚课题组结合计算与实验手段,采用手性侧链装订肽合成技术,并运用多尺度计算模拟方法,实现了针对由短肽形成的超螺旋纳米自组装结构的从头设计,并进一步在原子层面上理解了该结构形成的机制。此项研究以“Molecular Design of Stapled Pentapeptides as Building Blocks of Self-Assembled Coiled-Coil-Like Fibers”为题,在Science Advances在线发表,DOI,链接 :doi: 10.1126/sciadv.abd0492。
短肽分子具有良好的生物兼容性,且易于合成及修饰,因此已经成为制备自组装纳米结构的一类重要的构建单元。尽管这类自组装结构表现出独特的物理和化学特性,但由于短肽构象的自由度较高,它们往往缺乏特定氨基酸精确的空间排列。通过化学修饰的构象约束为这个问题提供了有效的解决方案。受到天然蛋白质中存在的一类特殊螺旋自组装结构的启发,科学家们致力于探索如何通过设计短肽来构建由螺旋肽形成的超螺旋纳米纤维结构。迄今为止所采用的方法主要是引入使螺旋构象稳定的非编码氨基酸,但这类方法通常会改变多肽主链的化学结构,导致多肽形成的螺旋结构不规则,这使得螺旋肽自组装结构设计和机制理解变得十分困难。所以,基于结构和机制的螺旋多肽自组装的理性设计尚付阙如。
除了主链修饰外,设计合适的侧链链接也是增加多肽螺旋度的重要策略。李子刚课题组在之前的研究中发现在多肽装订侧链精准引入手性中心,当手性中心是R型时,可以促使最短包含五个氨基酸的短肽形成稳定且结构标准的螺旋(Chirality Induced Helical Peptide, CIH多肽,图1A)【Angew. Chem. Int. Ed. 2016, 55, 8013】,之后他们发现在合适的条件下,这种螺旋多肽可以自组装形成纳米结构【Sci. Adv. 2018;4: eaar5907;CCS Chem. 2020, 2, 42】。这种装订肽策略在超螺旋结构设计中展现出潜在的应用价值。然而,目前对装订肽自组装机理认知的缺乏,如何通过合理设计调控这类装订肽的自组装行为仍然极具挑战。为此,韩伟课题组采用了独立开发的多尺度计算模型(hybrid-resolution model)对上述装订肽的自组装行为开展了计算模拟研究【J Chem Theory Comput 2012,8,4413】。该模型不仅可以用于多肽折叠和聚集机制的研究,最近还得到进一步拓展,并被用来阐明超短肽形成多种纳米结构的机理【J Chem Theory Comput 2017,13,5731;ACS Nano 2019,13,4455】。
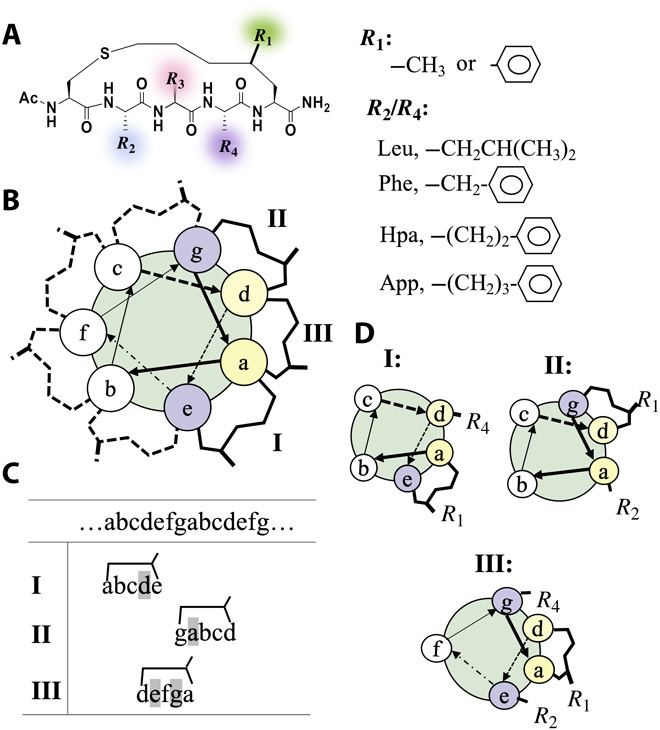
图1:Coiled coil结构规则及CIH五肽的设计。
研究者们首先按照只含有五个残基装订肽这个模版对超螺旋结构规则进行了调整(图1),并根据该模版构建了装订肽文库(表1),然后使用多尺度计算方法对该文库进行了筛选。结果表明,所使用的计算模型可以较准确地评估给定五肽形成螺旋构象的倾向以及其组装成纳米纤维的能力,并可有效预测其组装行为。这些信息不但辅助实验准确锁定可以高效自组装的装订肽,并且与多种实验表征手段互补,促进了研究者们对装订肽自组装结构细节的理解,从而让他们能够更加合理地对多肽进行设计改造,并且根据设计结果的反馈进一步改良设计。通过这种策略,研究者们首次从头设计了螺旋度可预测,可调控的CIH五肽并成功预测其纤维自组装行为。
表1:五肽文库及螺旋度与形貌。
Id |
R1 |
R2 |
R4 |
Computed Helicity |
Computed RelAtive Helicity |
Experiment ReLative Helicity |
Sshape |
S |
1 |
-Me |
Ala |
Leu |
0.71±0.02a |
0.77 |
0.78 |
0.49 |
0.29 |
2 |
-Ph |
Ala |
Leu |
0.54±0.09 |
0.59 |
0.59 |
0.39 |
0.35 |
3 |
-Me |
Leu |
Ala |
0.39±0.08 |
0.42 |
-b |
- |
- |
4 |
-Ph |
Leu |
Ala |
0.41±0.09 |
0.45 |
- |
0.48 |
0.39 |
5 |
-Me |
Ala |
Phe |
0.27±0.09 |
0.29 |
- |
- |
- |
6 |
-Ph |
Ala |
Phe |
0.19±0.05 |
0.21 |
0.27 |
0.38 |
0.38 |
7 |
-Me |
Ala |
Hpa |
0.68±0.10 |
0.74 |
- |
0.44 |
0.36 |
8 |
-Ph |
Ala |
Hpa |
0.58±0.08 |
0.63 |
0.65 |
0.53 |
0.32 |
9 |
-Me |
Ala |
App |
0.93±0.03 |
1.01 |
- |
0.62 |
0.35 |
10 |
-Ph |
Ala |
App |
0.92±0.06 |
1.00 |
1.00 |
0.97c |
0.06 |
11 |
-Me |
Phe |
Ala |
0.22±0.07 |
0.24 |
- |
- |
- |
12 |
-Ph |
Phe |
Ala |
0.26±0.04 |
0.28 |
0.35 |
- |
- |
13 |
-Me |
Hpa |
Ala |
0.34±0.10 |
0.37 |
- |
- |
- |
14 |
-Ph |
Hpa |
Ala |
0.30±0.10 |
0.33 |
- |
- |
- |
15 |
-Me |
App |
Ala |
0.34±0.09 |
0.37 |
- |
0.59 |
0.39 |
16 |
-Ph |
App |
Ala |
0.42±0.05 |
0.46 |
- |
- |
- |
17 |
-Me |
Leu |
Leu |
0.70±0.06 |
0.76 |
- |
0.37 |
0.32 |
18 |
-Ph |
Leu |
Leu |
0.66±0.02 |
0.72 |
- |
0.34 |
0.42 |
19 |
-Me |
App |
App |
0.94±0.08 |
1.02 |
- |
0.25 |
0.36 |
20 |
-Ph |
App |
App |
0.82±0.10 |
0.89 |
- |
0.25 |
0.36 |
DerivativeS of peptide 10 |
|
|
|
|
|
21 |
Ala2Lys (A2K) |
0.86±0.08 |
0.93 |
0.96 |
0.94 |
0.06 |
22 |
Ala3Lys (A3K) |
0.95±0.04 |
1.03 |
1.01 |
0.98 |
0.096 |
23 |
Ala2Glu (A2E) |
0.94±0.05 |
1.02 |
0.88 |
0.98 |
0.08 |
24 |
Ala3Glu (A3E) |
0.95±0.08 |
1.03 |
0.92 |
0.91 |
0.08 |
特别值得指出的是CIH五肽纤维形成能力对化学取代细节极为敏感。当研究者改变位于R4位置的苯丙基酸残基,将其取代为苯环基团(Ph)和主链间的C原子个数不同的苯丙氨酸类似物时,多肽的螺旋度随之受到显著的影响,而其自组装行为也发生改变。进一步的计算模拟和实验表明,单个亚甲基的微小差异对肽的组装能力的巨大影响归因于CIH多肽的螺旋度变化。Phe具有最短的单个亚甲基,其Ph基团对多肽螺旋骨架造成位阻,严重降低了多肽的螺旋度;而使用多一个亚甲基的Hpa取代基可降低这种位阻,提高螺旋度;当使用更多一个亚甲基的App时,其足够的长度避免了Ph与CIH多肽螺旋骨架的位阻并和侧链之间形成良好的相互作用,从而进一步稳定了CIH多肽的螺旋构象。此外,较长的链接基团也使得Ph基团具有足够多的自由度,从而能够参与分子间的芳香环相互作用;与此相反,如果Ph过分靠近多肽主链,由于空间位阻的关系,其形成分子间芳环主要的能力则被大大削弱。此外,研究者们还研究了特定的疏水、氢键相互作用对纤维形成的重要性。综上所述,以上发现不但为超螺旋自组装多肽设计开辟了一条新途径,而且在理解超短螺旋多肽的自组装机制上也具有重要意义(图2)。
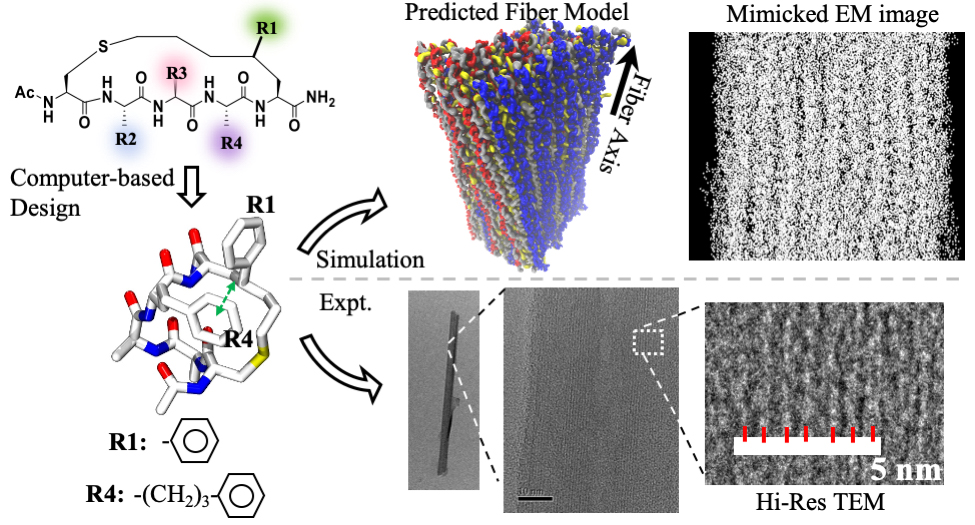
图2:实验整体设计及核心表征。
此研究由韩伟教授课题组和李子刚教授课题组合作完成,北京大学深圳研究生院博士研究生江意翔、张婉和杨发灯为共同第一作者; 蔡翔、万川和刘建博等也做出了重要贡献。以上工作得到了国家科技部、国家自然科学基金、广东自然科学基金、深圳市科技创新委员会及中国博后科学基金的支持。