近日,李子刚/尹丰课题组与深圳湾实验室周耀旗课题组合作,开发了一种新型的针对新冠病毒(SARS-CoV-2)木瓜蛋白酶样蛋白酶(PLpro)蛋白的多肽-药物偶联物(PDCs),其成果发表在药物化学期刊《Journal of Medicinal Chemistry》上,题目为“Design and Evaluation of a Novel Peptide-Drug Conjugate Covalently Targeting SARS-CoV-2 Papain-Like Protease (PLpro)”。
新冠病毒自2019年底开始全球肆虐,严重影响了全人类的生命安全。虽然疫苗的开发减缓了病毒的传播,但由于不断出现的新的变体病毒,对抗新冠病毒的研发工作,道阻且长。Molnupiravir具有良好的治疗效果、安全性、耐受性和口服生物利用度被特批为目前唯一的口服抗病毒药物。但由于其研究时间尚短,是否存在一定风险还需要进一步验证。开发有效的抗新冠病毒药物仍是目前的当务之急。
新冠病毒PLpro由于其在病毒病毒复制、干扰宿主的免疫应答等有多种功能,因此被认为是一个非常有潜力的抗病毒药物靶点。已报道的靶向PLpro的抑制剂 GRL0617,占据干扰素刺激的基因15 (ISG15)的C端的结合口袋,并在细胞内显示出有效的抗病毒作用。PDCs是一类被广泛设计和合成的新型药物载体,在这项工作中,作者以GRL0617作为PDCs的药物模板,通过与一段锍盐稳定的多肽偶联,设计了一组共价PDCs,以提高GRL0617的靶向特异性与作用时间。其中EC-M显示出体外的PLpro活性抑制, IC50为8.63±0.55 µM,并且EC-M可以选择性的共价标记到PLpro活性位点C111。此外PDCs显着降低了GRL0617的细胞毒性。在抗ISG15免疫印迹试验中,两种PDC(EC-M和EM-C)均能以剂量依赖的方式恢复被SARS-CoV-2 PLpro抑制的细胞ISGylation水平,EC-M显示出在细胞水平上IFN-β启动子活性的恢复。这些结果表明,EC-M不仅可以通过抑制SARS-CoV-2的一种必需蛋白酶来潜在地干扰SARS-CoV-2复制,还可以重新激活宿主对病毒感染的先天免疫反应。此工作首次尝试了由稳定多肽抑制剂和GRL0617组成的多肽-药物偶联物来抑制SARS-CoV-2 PLpro的可能性。这些新型PDCs为抗病毒药物设计提供了新的机会,同时这种 PDCs 设计策略可应用于靶向治疗应用的其他重要蛋白质。
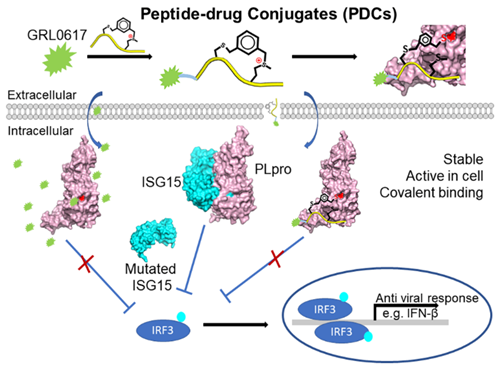
图1:共价靶向SARS-CoV-2 PLpro的多肽-药物偶联物(PDCs)示意图。
北京大学深圳研究生院博士研究生刘娜,章亦弛和深圳湾实验室的雷颖首为该论文的并列第一作者,北京大学深圳研究生院李子刚教授、深圳湾实验室坪山生物医药研发转化中心尹丰研究员和深圳湾实验室詹剑副研究员为共同通讯。以上工作得到了国家自然科学基金,国家重点研发计划“合成生物学”重点专项,广东省自然科学基金,深圳市科技创新委员会,北京分子科学国家实验室开放资助,深港脑科学研究所-深圳基础研究机构资助,深圳湾实验室重大计划和深圳湾实验室开放计划的财政支持,以及国家重点实验室自主研究重点课题项目支持。
论文链接: https://pubs.acs.org/doi/10.1021/acs.jmedchem.1c02022