韩伟课题组运用多尺度计算模拟方法,对β淀粉样蛋白(Aβ)聚集过程进行了大尺度模拟,深入研究了早期阶段产生的Aβ多聚体的拓扑结构和形成机理,在分子层次上揭示了Aβ致病与非致病亚型之间在早期自组装过程的差异,为理解Aβ多聚体毒性产生机制提供了重要的结构细节。此项研究以“Anatomy and Formation Mechanisms of Early Amyloid-β Oligomers with Lateral Branching: Graph Network Analysis on Large-Scale Simulations”为题目,发表在国际知名期刊《Chemical Science》上。
Aβ多肽早期聚集形成的多聚体在阿尔茨海默病的发生和发展过程中起着关键作用,因此这类多聚体的结构和形成机制引起了人们极大的研究兴趣。然而,Aβ多聚体结构具有瞬时性和非均相性,很难通过现有的实验手段对其进行精细的表征。虽然计算模拟可以弥补实验表征方面的不足,提供生物分子动态结构细节,但是Aβ多肽的聚集过程过于复杂,对该过程的大规模计算模拟极具挑战性。因此,尽管大量实验证据表明大尺寸的Aβ多聚体与阿尔兹海默症在病理学上最为相关,迄今为止的计算模拟研究往往只能围绕小尺寸的Aβ低聚物而开展。最近高分辨率成像实验证实大尺寸的Aβ多聚体结构呈不规则形状,且具有分支,这与模拟中观察到的小尺寸低聚物具有显著差异。然而,由于缺乏有效的实验和计算模拟表征手段,这些大尺寸多聚体结构的分子细节和形成机制尚不清楚。
为了克服上述困难,韩伟课题组使用自主开发的多尺度计算模型(ACS Nano, 2019, 13, 4455; J Chem Theory Comput, 2012, 8, 4413)对早期Aβ多肽的聚集过程进行了研究。该模型能够在接近原子分辨率的状态下对Aβ多肽进行模拟,而且相比于已报道的研究,能够大幅提升模拟的规模以及采样的时长(约一个数量级)。这使得针对大尺寸Aβ多聚体的模拟结果可靠性得到显著提升。另外,该研究通过使用图网络方法系统地分析了模拟结果,表征了大尺寸Aβ多聚体的拓扑特征,发现这类多聚体呈现高度弯曲、不规则的条状外形,且含有分支结构,这种形貌特征与最近的冷冻电镜实验观测结果十分吻合。此外,研究人员发现Aβ40比细胞毒性更高的Aβ42亚型更容易形成含分支结构的多聚体,并证明Aβ40形成分支的能力主要来源于其在多聚体骨架与分支间界面所形成的特定多肽-多肽相互作用,揭示了潜在的抑制剂设计靶点。对多肽自组装动力学的分析还进一步揭示了Aβ多聚体延伸和分支机制对其尺寸和形状具有复杂的依赖性。这些发现为深入理解Aβ聚集过程早期多聚体形成机制以及Aβ亚型间毒性差异提供了新的研究视角,为相关抑制剂的设计提出了新思路。
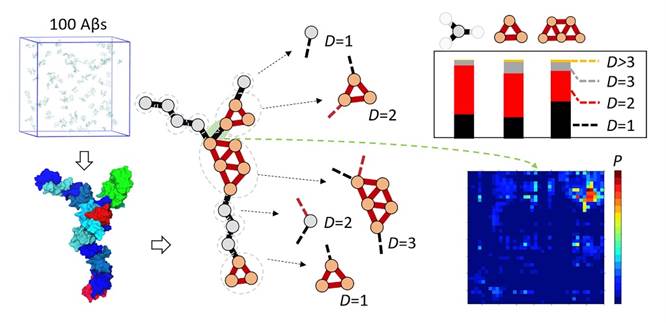
图1:大尺度模拟及拓扑网络分析揭示Aβ聚集早期多聚体的形成机理
该研究在北京大学深圳研究生院韩伟老师指导下完成,北京大学深圳研究生院博士研究生员苗同学为该论文的第一作者,唐璇同学在该论文的研究阶段也做出了重要的贡献。以上工作得到省部共建肿瘤化学基因组学国家重点实验室、国家自然科学基金和深圳基础研究高校稳定支持项目的支持。
论文链接:https://doi.org/10.1039/D1SC06337E