肺是呼吸系统的主要器官,其借助外呼吸功能不断给机体提供氧气,排出二氧化碳,以维持机体血气平衡和内环境稳定。许多病理性因素可导致肺部功能发生改变,从而导致肺部疾病甚至危及生命。目前肺动脉高压和败血症致死率高,治疗药物疗效差,仅能改善患者的生活质量,对于一些严重病人,最终只能求助于肺或者心脏移植手术。进一步深入研究肺部疾病的发病机制,开发有效的治疗策略和药物是医药界刻不容缓的使命。
北京大学深圳研究生院化学生物学与生物技术学院科研团队通过构建内皮细胞和平滑肌细胞特异性Pfkfb3敲除小鼠,利用慢性缺氧诱导小鼠,来复制肺动脉高压模型。研究结果表明,内皮细胞特异性敲除Pfkfb3后,显著降低了内皮细胞的糖酵解水平,进而抑制了糖酵解代谢产物丙酮酸的产生。丙酮酸水平降低则对PHDs的抑制能力减弱,结果使细胞中HIF2A被降解增多,最终使生长因子、促炎细胞因子和细胞黏附因子的表达降低,进而抑制肺血管平滑肌细胞的异常增殖,以及肺血管周炎症细胞的浸润,抑制了缺氧诱导的肺动脉高压的发展(图1)。该研究成果于2019年6月发表在PNAS杂志上(论文链接:https://www.pnas.org/content/pnas/early/2019/06/17/1821401116.full.pdf)
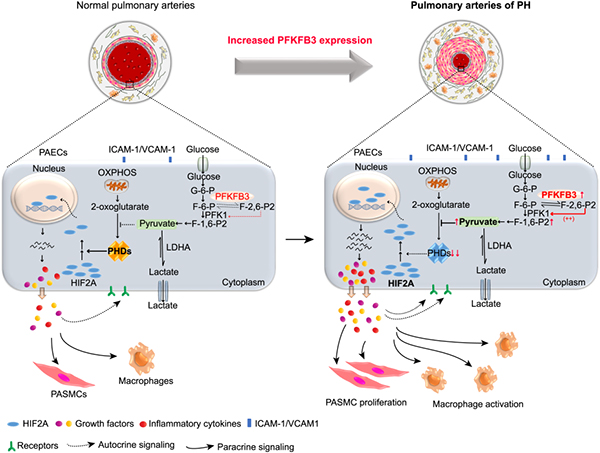
图1. 内皮细胞中PFKFB3介导的糖酵解对肺动脉高压发展的影响模式图
在研究人员参与的另一项关于平滑肌糖酵解的项目中发现,平滑肌细胞特异性敲除Pfkfb3后,糖酵解的代谢产物乳酸含量减少,导致依赖ERK1/2的calpain-2的磷酸化激活被减少,引起肺血管平滑肌细胞中骨胶原合成减少,平滑肌细胞的异常增殖也减弱,进而抑制了肺动脉高压发展过程中的肺血管重构(图2)。该研究成果于2019年2月发表在呼吸疾病顶级期刊AJRCCM杂志上(IF16, 论文链接:https://www.atsjournals.org/doi/abs/10.1164/rccm.201812-2290OC)。
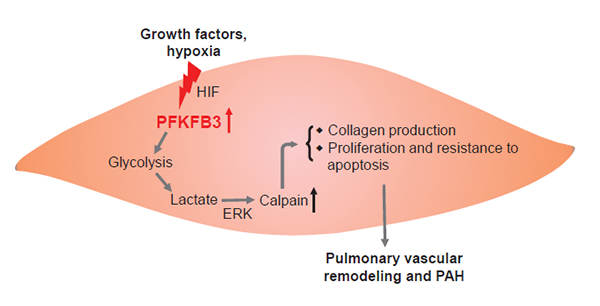
图2. 平滑肌细胞中PFKFB3介导的糖酵解对肺动脉高压发展的影响模式图
此外,研究人员还发现内皮细胞特异性Pfkfb3敲除可以保护小鼠免于LPS引起的败血症和急性肺损伤,内皮细胞PFKFB3可以通过NF-κB信号通路调控粘附因子ICAM-1、VCAM-1的表达以及炎症因子IL-1β、TNF-α的释放,从而促进由于过度的炎症反应造成的组织损伤(图3)。该研究成果于2019年6月发表在Pharmacological Research杂志上(论文链接:https://www.sciencedirect.com/science/article/pii/S1043661819303536?via%3Dihub)。
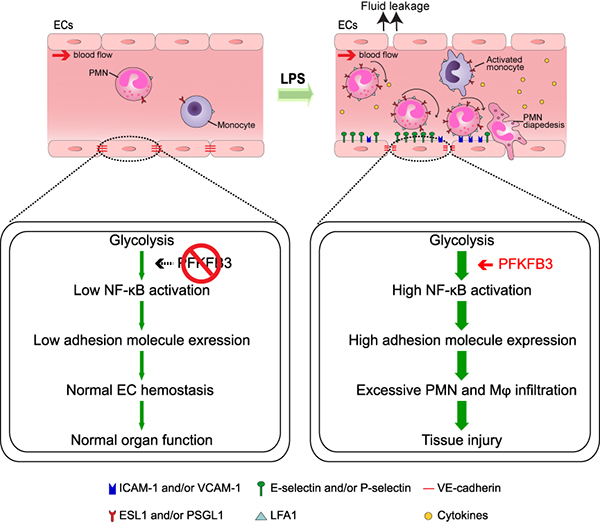
图3. 内皮细胞中PFKFB3介导的糖酵解对LPS引起的败血症的影响模式图
上述系列研究全面且深入的揭示了血管细胞PFKFB3分子在多种严重肺疾病中的作用。为PFKFB3药物开发及临床应用打下了坚实的基础。
上述系列研究由多位研究生包括曹亚朋和王莉娜同学协作完成,化生院洪梅老师和全军民老师及美国乔治亚洲佐治亚医学院血管生物学中心霍玉庆老师合作指导上述科研工作。该系列研究由深圳市科创委及美国NIH资金支持。