近日欧阳昆富课题组在自然杂志子刊《Cell Death & Differentiation》在线发表了题为 “Deletion of heat shock protein 60 in adult mouse cardiomyocytes perturbs mitochondrial protein homeostasis and causes heart failure.”的论文。该工作揭示了线粒体热休克蛋白HSP60在维持线粒体蛋白质稳态平衡方面起重要作用。在成年小鼠心肌细胞中敲除HSP60会引起线粒体蛋白稳态失衡与线粒体功能失常,并最终导致扩张型心肌病与心衰。
线粒体对于维持心肌细胞正常功能具有至关重要的作用,线粒体结构与功能异常会导致心肌病的发生与发展。在成年心肌细胞中,线粒体不仅提供细胞收缩所需90%以上的ATP,也是细胞内重要的钙库之一。同时,线粒体在磷脂代谢、活性氧生成与细胞凋亡等过程中都起着非常重要的作用。线粒体中约有1500个蛋白,除13个线粒体基因组编码的蛋白质外,其他由核基因组编码的蛋白质在穿过线粒体双层膜后需要进行正确折叠才能发挥正常功能。这一过程主要由HSP60、HSP70以及其他热休克蛋白来完成,而如果线粒体未折叠或不正确折叠蛋白积累过多则会引起线粒体未折叠蛋白应答。HSP60与HSP10组成的复合物参与线粒体蛋白折叠过程,但是一直以来人们对于HSP60在哺乳动物中的生理功能特别是心脏中的功能尚不清楚,对于哪些线粒体蛋白受HSP60调控也不清楚。利用Cre-Loxp系统,在小鼠成年心肌细胞中敲除HSP60会引起线粒体功能异常,导致扩张型心肌病与收缩功能下调,并伴随着细胞凋亡的增加,最终引起心力衰竭与小鼠死亡。利用蛋白质组学技术鉴定出670多种线粒体蛋白,其中可能依赖于HSP60进行折叠的蛋白质约有120个。当HSP60敲除后,这些蛋白无法正确折叠,在早期会通过线粒体蛋白酶LONP1进行降解,而HSP60非依赖的蛋白则没有影响。随着时间进程,未正确折叠蛋白增多,最后会引起线粒体未折叠蛋白应答与线粒体功能异常,并导致心脏疾病。这个研究不仅为人们提供了线粒体功能异常致心脏病的小鼠模型,同时也为深入理解线粒体蛋白质稳态的控制提供了重要的实验证据。
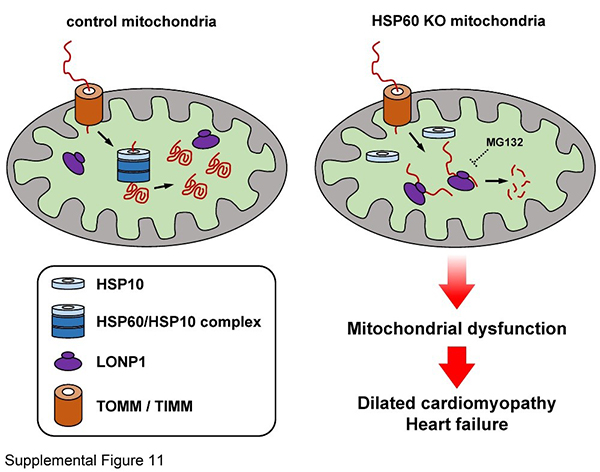
HSP60敲除诱导线粒体蛋白质稳态失衡与心脏功能异常示意图
课题组博士研究生范飞飞、段瑶芸与杨飞丽为本论文共同第一作者。北京大学深圳研究生院为论文第一完成单位,合作单位还包括深圳大学、深圳北大医院、深圳人民医院与美国加州大学圣地亚哥分校。以上工作得到了科技部973项目子课题与深圳市科技创新委员会的资助。
论文链接:https://www.nature.com/articles/s41418-019-0374-x