李子刚教授课题组近日在国际著名医学期刊《Theranostics》(治疗诊断,IF: 8.9)上在线发表题为 “SiRNA Delivery with PEGylated Graphene Oxide Nanosheets for Combined Photothermal and Genetherapy for Pancreatic Cancer” 文章,报道了功能化的氧化石墨烯有望成为一种新型高效低毒基因递送载体在胰腺癌治疗中的应用。
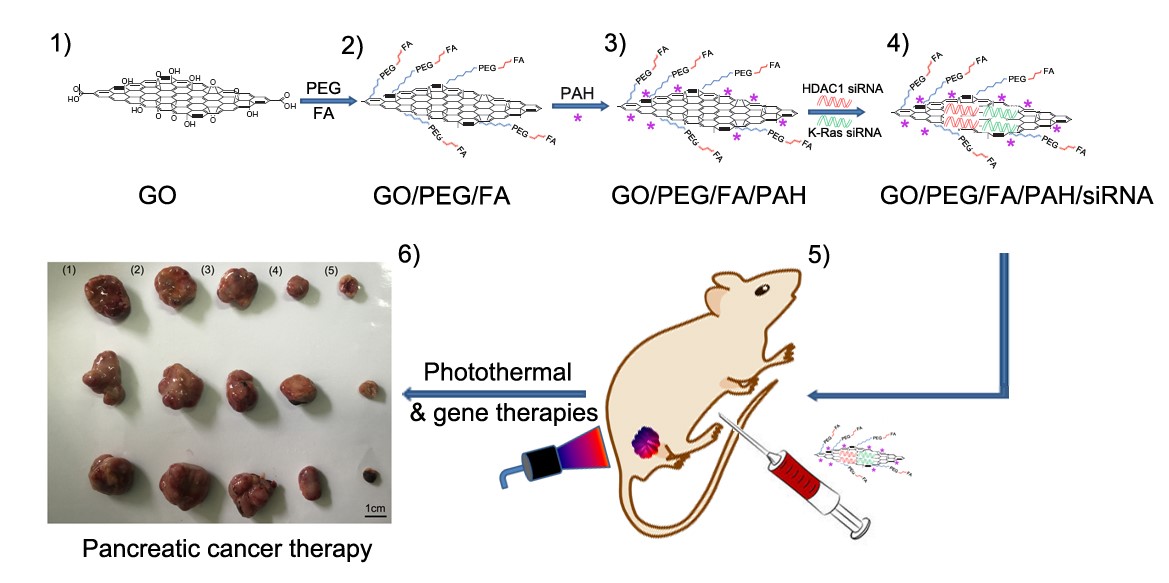
作为新型二维纳米材料石墨烯的重要衍生物,氧化石墨烯(GO)在生物医学领域的应用研究引起了人们的广泛兴趣,已经成为纳米生物医学,尤其是纳米载药的研究热点之一。GO作为纳米载药系统的主要优点包括:(1)具有超大的比表面,从而可以实现超高载药率;(2)具有很强的靶向性,容易在肿瘤部位富集;(3)功能化GO在生理条件下具有良好的生物相容性和稳定性。此外,氧化石墨烯本身具有特殊的近红外区的光热转换效率,是一种良好的纳米光热治疗的药物。
RNA干扰(RNAi)作为后基因组时代的一种下调基因表达的工具已被广泛用于基因功能的研究以及疾病的治疗。近年来随着RNA干扰技术在生命领域的应用以及研究的深入,RNA干扰成为了生命科学领域的一个研究热点。小干扰RNA (siRNA)介导的RNA干扰正是通过下调致病基因从而对很多人类疾病实现治疗,如癌症、自身免疫性疾病以及病毒感染性疾病等。但由于siRNA自身的局限性(细胞内不稳定性、肾清除率高、细胞通透性差等)使其不能直接用于疾病治疗,需要通过良好的运输体系的运输才能实现其临床应用的潜力。因此设计并实现一种理想的运输体系是研究者们一直追求的目标。
本课题中,研究人员使用聚合物修饰GO,一方面提高GO的水溶性,另一方面大大提高了GO运载siRNA的能力。同时,使用叶酸分子修饰GO,大大提高了GO复合物的肿瘤部位靶向性。研究表明,修饰过后的GO可以同时将HDAC1以及Kras1基因的SiRNA高选择性的运送到胰腺癌细胞Mia PaCa-2中,抑制 HDAC1以及KRas基因的表达,体内抑瘤吕达到了80%以上,且没有表现出任何毒副作用。通过研究结果表明,功能化的氧化石墨烯有望成为一种新型高效低毒基因递送载体。同时,纳米药物光热疗法与基因疗法结合,二者可以协同作用,显著提升抗肿瘤的效果。
本研究由李子刚副教授指导完成,博士后尹丰、博士研究生胡宽和其他课题组成员合作完成。特别感谢:南方科技大学的梁永晔教授在GO制备以及表征方面提供了帮助,北京大学深圳研究生院的卢菲副教授在细胞实验以及动物实验方面提供了帮助,南洋理工大学的Ken-Tye Yong教授在文章撰写方面提供了帮助。李子刚课题组目前在药物递送领域已开展多项研究,后续工作将陆续报导。该工作得到了国家自然科学基金,深圳市创新基金以及深圳市孔雀计划项目的资助。(文字/尹丰)
论文链接:http://www.thno.org/v07p1133.htm