增殖性视网膜病变(proliferative retinopathy, PR)病发于各个年龄阶段,包括早产儿视网膜病变、糖尿病增殖性视网膜病变 (proliferative diabetic retinopathy, PDR)、老年性黄斑病变等,是致盲的主要原因。此类疾病的的共同病理特征是视网膜或脉络膜新生血管过度生长,引发纤维瘢痕形成,并伴随血管内皮炎症及通透性增加,导致硬性渗出,黄斑水肿和视网膜脱落,最终使患者视力严重受损甚至失明。PR传统的治疗手段主要是采用激光或冷冻手术切除视网膜的病变部位,然而这种方法效果有限并容易对视网膜造成不同程度的损伤。目前PR药物治疗主要依靠血管内皮生长因子VEGF拮抗剂,但其治疗效果仅在部分病人有效,并存在不可控的副作用。鉴于目前PR干预手段单一,缺乏安全有效的防治药物的现状,进一步探索其发病机制,寻找新的可干预潜在靶点成为PR防治的当务之急。
近日,我院霍玉庆/洪梅课题组在《自然通讯》(Nature Communications)上在线发表题为" Endothelial adenosine A2a receptor-mediated glycolysis is essential for pathological retinal angiogenesis" 的研究论文(DOI: 10.1038/s41467-017-00551-2),深入阐释了腺苷受体A2A (ADORA2A) 调控视网膜微血管内皮细胞糖酵解和病理性血管新生的分子机制,为确立ADORA2A作为PR新的干预靶点及相关药物研发提供了重要理论依据。
腺苷是一种独特的细胞代谢调节物,能够影响细胞多种生理过程从而调节机体不同组织器官的生理功能。细胞外腺苷对不同细胞生理过程的调节作用主要是通过分布在细胞膜上的腺苷受体(Adenosine receptors, ARs)介导的。ARs属G蛋白偶联受体,包括四种亚型:ADORA1, ADORA2A, ADORA2B和ADORA3。有研究人员对I型糖尿病病人进行长达20年的跟踪研究发现,ADORA2A基因变异(SNP rs2236624和SNP rs4822489)与PDR的发病率呈显著的相关性。本研究中,霍玉庆/洪梅课题组通过对NIH数据库的临床资料分析发现I型糖尿病病人的ADORA2A基因当有与高糖尿病视网膜病变的SNPs发生时,其ADORA2A mRNA表达上调(rs2236624, P=0.08; 和rs4822489, P<0 .01);体外研究发现,当人视网膜微血管内皮细胞暴露于缺氧环境下,adora2a表达显著上调,而其它三种ars的表达水平则无明显改变,提示视网膜组织缺血缺氧环境下内皮细胞腺苷-adora2a信号的过度激活可能是pr发生发展的关键因素。他们进一步的机制研究揭示了活化的g蛋白偶联受体adora2a启动下游erk1/2及akt激酶磷酸化激活,并进一步活化下游蛋白翻译起始因子p70s6k和eif-4e,促进hif1α蛋白合成而介导糖酵解基因的转录,从而增强内皮细胞的糖酵解代谢功能,进而引发内皮细胞增殖、出芽、顶端细胞以及官腔形成,最终导致视网膜病理性血管生成 (图1)。
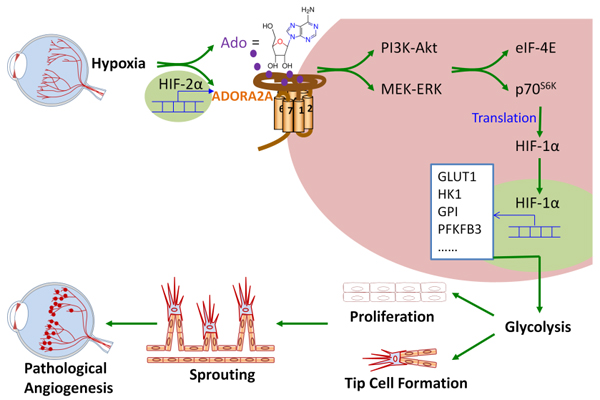
图1 腺苷-ADORA2A信号调节通路介导视网膜病理性血管生成的作用机制示意图
本研究由刘志平博士以及多位课题组成员合作完成,以上工作得到了国家自然科学基金委员会,深圳市科技创新委员会及深圳市孔雀计划项目的资助。
论文链接:https://www.nature.com/articles/s41467-017-00551-2