近日,北京大学深圳研究生院化学生物学与生物技术学院李子刚教授/尹丰研究员课题组在纳米材料领域国际知名期刊ACS nano(SCI一区,影响因子18.027)上发表题为“Sulfonium-Driven Neoantigen-Released DNA Nanodevice as a Precise Vaccine for Tumor Immunotherapy and Prevention”的文章(DOI: 10.1021/acsnano.2c09708),阐述了一种基于锍盐中心的DNA折纸纳米递送系统,用于新抗原递送和肿瘤免疫治疗。
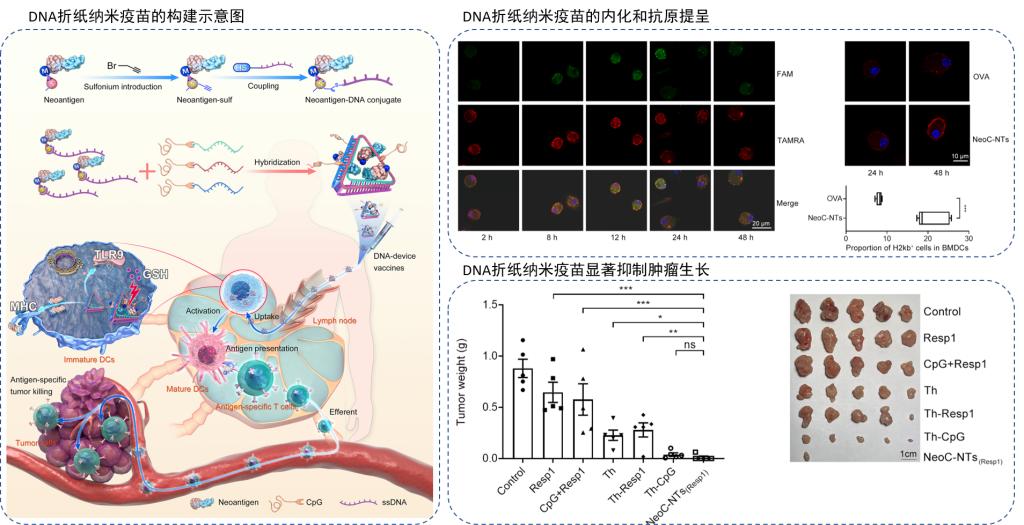
基于多肽的肿瘤新抗原具有良好的安全性、易生产等特性,由其制成的疫苗在肿瘤个性化免疫治疗的效果已在临床上得到验证。然而由于新抗原在肿瘤细胞表面表达丰度低、肿瘤异质性、以及多肽自身稳定性和穿膜能力有限等问题,导致新抗原肽疫苗的临床治疗效果一直不理想。新抗原肽的有效递送和可控释放是激活特异性、持续性免疫响应的关键。在众多纳米载体中,可编程的DNA折纸纳米载体可为药物提供精确的固定位置,具有作为智能型纳米递送载体的巨大应用潜力。
在这里,我们借助炔丙基锍盐驱动的高效、可逆生物正交反应,构建获得了新抗原肽-核酸共价偶联物,并借助DNA碱基互补配对原则将已知数量的新抗原肽引入到DNA折纸中。该纳米疫苗不仅表现出具有良好的血清稳定性和生物安全性,同时可有效携带抗原肽穿透细胞膜进入抗原提成细胞(RAW264.7和BMDCs)。此外,借助锍盐中心的可逆性,内化后的纳米疫苗在胞内GSH的作用下释放出抗原肽,进一步诱导下游抗原提呈和免疫系统活化。
体外实验显示,纳米疫苗显著增强了肿瘤相关细胞因子(TNF-α、IL-6和IL-12)的分泌。在动物水平,同时携载了模式抗原肽OVA和CpG佐剂的DNA折纸纳米疫苗可激活抗原特异性CD8+T细胞响应,有效预防了黑色素瘤的肺转移。在B16-OVA荷瘤小鼠模型中,纳米疫苗给药组可抑制50%的黑色素瘤生长。同样的,将OVA替换为结肠癌新抗原后,含有新抗原的DNA纳米疫苗可诱导最大程度的MC-38肿瘤完全消退。综上,这项研究表明具有可逆锍盐中心的DNA折纸纳米载体为肿瘤免疫治疗和肿瘤预防提供一种新型的、生物相容性的、抗原佐剂共递送平台,未来有望为多种途径联合的肿瘤治疗方案设计(化疗、核酸药物治疗、多肽药物治疗等)提供参考。
该工作由北京大学深圳研究生院李子刚教授/尹丰研究员课题组完成,并得到深圳市第二人民医院朱礼志课题组和深圳湾实验室坪山生物医药研发转化中心的支持和帮助。北京大学深圳研究生院化学生物学与生物技术学院博士后张亚萍为第一作者,化学生物学与生物技术学院徐红坤、姜乐盈、深圳湾实验室坪山生物医药研发转化中心廉晨珊等也做出了重要贡献。上述研究得到了国家自然科学基金项目、广东省基础与应用研究项目、深圳市科技创新委员会基础研究项目的支持。
文章链接: https://doi.org/10.1021/acsnano.2c09708